货号:056-05921
测序级 天冬酰蛋白内切酶
Endoproteinase Asp-N, Sequencing grade
用于生物化学
CAS:9001-92-7
EC编码:3.4.24.33
EINECS编号:232-642-4
MDL编号:MFCD02253021
GHS: Danger
天冬酰蛋白内切酶简介
使用蛋白酶裂解多肽链的条件较温和,因此氨基酸残基侧链的修饰(氧化,卤代,脱酰胺等)并不会发生,含有这些基团修饰(结合位点在碳水化合物链,脂类、磷酸酯,硫酸等)的多肽通常会以完整形式良好收率回收。在相同消解条件下,得到片段的重现性很好。蛋白质的一级结构分析使用高底物特异性的酶,因为从氨基酸组成可以大致预测片段数量及其平均大小。更重要的是,可以避免由于部分(非特异性)裂解导致分离复杂。
天冬酰蛋白内切酶 Asp-N 是一种金属内切蛋白酶。它来自于Pseudomonas fragi的一个突变菌株。这种酶专一地切割蛋白质和多肽中天冬氨酸和半胱氨酸残基的N末端。抑制剂:抑肽酶、二异丙基氟磷酸(DFP)、亮肽和TLCK。特异性:以胰高血糖素为底物1小时后的反应率:≥90%。
天冬酰蛋白内切酶性质
外观:冻干粉末
来源:Pseudomonas fragi 突变种
比活:使用偶氮骨胶原蛋白(azocoll)作为底物,在37℃下,≥20000 units/mg 蛋白质
纯度:≥90 % (SDS-PAGE)
天冬酰蛋白内切酶应用
<
因其对多肽的高度特异性剪切,在蛋白质组学中用于肽链分析和蛋白质序列工作。
用于特定蛋白质的消化以制备肽,并通过质谱法分析生成的肽结构。
天冬酰蛋白内切酶产品列表
|
货号
|
产品
|
包装
|
级别
|
|
056-05921
|
Endoproteinase Asp-N, Sequencing grade
测序级 天冬酰蛋白内切酶 Asp-N
|
2ug
|
生化试剂
|
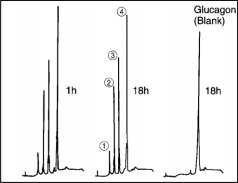
天冬酰蛋白内切酶重组和蛋白酶活性:
重组:加入50μl无菌蒸馏水至10mmol/l Tris HCl缓冲液中溶解,pH7.5。
消解特异性:以胰高血糖素为底物,消解反应1h后,反应率达90%以上。
H-S-Q-G-T-F-T-S-D-Y-S-K-Y-L-D-S-R-R-A-Q-D-F-V-Q-W-L-M-N-T Glucagon
① Asp (15)-Gln (20), ② His (1)-Ser (8), ③ Asp (9)-Leu (14), ④ Asp (21)-Thr (29)
消解液:100μg胰高血糖素+10μg测序级天冬酰蛋白内切酶溶于磷酸钠缓冲溶液 (50 mmol/l, pH 8.0) 1小时,37℃下培养18小时。
样品:20 μl消解液
柱子:Shandon ODS Hypersil , 5 μm
分离条件:
溶剂A: Water (contain 0.1 vol% TFA)
溶剂B: Acetonitrile : H2O=70 : 30 (contain 0.1vol% TFA)
梯度:20分钟线性梯度0-100% B
流速:1 ml/min
检测波长:215 nm
贮存:2-10℃。等份溶液长期保存应置于-20℃冻存。贮存液在4℃可稳定保存2天,在-20℃可保存至1个月。
包装尺寸:2μg
天冬酰蛋白内切酶参考资料
(1) Noreau. J. andDrapeau, G. R. : J. Bacteriol., 140, 911 (1979)
(2) Drapeau, G. R., : J. Biol. Chem., 225, 839 (1980)
(3) Laemmli, U. K., : Nature, 227, 680 (1970)